媒体报道 | 秦叔逵教授专访:HIMALAYA研究6年OS数据惊艳亮相,STRIDE方案持续刷新uHCC患者长生存新高
研究速递
HIMALAYA研究全球队列6年随访数据显示,STRIDE方案组的6年OS率达17.1%,约为索拉非尼对照组的2倍,这也是uHCC一线治疗目前公布的首个6年OS数据。
中国扩展队列与全球队列汇总分析进一步显示,STRIDE方案在更广泛的uHCC患者群体(含HBV感染患者)中OS获益显著,3年OS率达31%,安全性可控可管理。
HIMALAYA研究的长期生存随访及其数据公布,再次有力地证实了双免治疗方案的“拖尾效应”。这一成果使HCC能与肺癌、乳腺癌等癌种比肩,开始以“五年及以上的生存率”来衡量疗效,为整个肿瘤学界带来了深远启迪。
引 言
2025年欧洲肿瘤内科学会(ESMO)年会于当地时间2025年10月17日-21日在德国柏林隆重召开。作为全球肿瘤学领域最具影响力的学术会议之一,ESMO年会汇聚了来自世界各地的肿瘤领域顶尖专家学者,共同探讨肿瘤领域临床诊疗难点、突破性发现与前沿疗法,持续推动全球肿瘤治疗理念与策略的革新。
本次大会上,HIMALAYA研究(摘要号:1494P)公布了中国扩展队列和全球队列的汇总分析(Pooled Analysis)结果以及全球队列的6年随访数据1,引起学界广泛关注,为全球多样化不可切除肝细胞癌(uHCC)患者群体的长期生存书写了新的记录。中国药科大学附属上海高博肿瘤医院荣誉院长、南京天印山医院秦叔逵教授,回顾HIMALAYA研究既往数据,并结合本次ESMO更新内容进行深度梳理与点评,剖析其对于uHCC患者长生存策略的深刻影响,以期为临床提供前沿的学术参考与实践指导。
uHCC一线治疗新突破
HIMALAYA 研究6年OS结果重磅发布,为HCC患者长期生存获益树立新标杆
PART.01
研究背景
原发性肝细胞癌(HCC)是全球癌症相关死亡的重要原因。据统计,中国HCC发病率居全球首位,其中超80%的病例与HBV感染相关,这使得HBV相关HCC的治疗面临独特挑战2。近年来,免疫检查点抑制剂在包括 HCC 在内的实体瘤治疗中取得了突破性进展。其中,双免疫联合治疗在uHCC患者的一线治疗领域也显示出令人鼓舞的结果。
HIMALAYA研究是全球首个双免(度伐利尤单抗+tremelimumab)联合方案一线治疗uHCC获得预期阳性结果的III期临床研究3。根据HIMALAYA研究结果,STRIDE方案[单次曲美木单抗(tremelimumab)联合间隔度伐利尤单抗(durvalumab)维持给药]在美国、欧盟和日本等多个国家/地区获批用于治疗uHCC患者,并被多部国内外肝癌权威指南推荐(包括CSCO及NCCN指南等)4,5。后随访时间延长至5年,STRIDE方案相较索拉非尼持续展现出持久的总生存期(OS)获益,两组OS率分别为19.6%和9.4%(HR=0.76;95%CI,0.65-0.89),标准着uHCC治疗正式进入长生存时代3,6。
在全球队列中,中国香港地区及中国台湾地区患者亚组的中位OS长达29.4个月,为已公布Ⅲ期研究中的中国人群领先数据,近一半患者可存活超过3年。客观缓解率(ORR)高达33.9%(研究者根据RECIST v1.1标准评估),提示毎3例患者中即有1例可实现肿瘤缓解6。此外,中国大陆还开展了HIMALAYA研究的扩展队列,观察到STRIDE方案对比索拉非尼具有一致的OS获益(HR=0.76;95%CI,0.49-1.18),安全性可管理,总体结果与全球队列相似。
本次ESMO公布的结果,旨在通过汇总分析HIMALAYA研究中的中国扩展队列和全球队列,探索在更广泛的uHCC患者群体中报告STRIDE方案和度伐利尤单抗单药治疗对比索拉非尼的结局,并同时报告了HIMALAYA全球队列中STRIDE方案和度伐利尤单抗单药治疗长达6年随访的OS更新分析结果,进一步更新STRIDE方案的长生存数据。
PART.02
研究设计
HIMALAYA是一项随机、开放标签、多中心、全球III期研究,共纳入1351例uHCC患者(中国扩展队列n=180,全球队列n=1171),随机分配至STRIDE方案组(n=453)、度伐利尤单抗单药组(n=453)或索拉非尼组(n=445)。本次分析的数据截止时间(DCO)为:中国扩展队列截至2024年9月26日(STRIDE组和索拉非尼组OS数据成熟度69%),全球队列截至2021年8月27日(STRIDE组和索拉非尼组OS数据成熟度71%);6年随访数据截止日期为2025年3月3日。
中国扩展队列及全球队列的汇总分析中,主要研究终点为STRIDE组对比索拉非尼组的OS,次要终点包括度伐利尤单抗组对比索拉非尼组的OS,12个月、18个月、24个月和36个月的OS率,研究者根据RECIST v1.1标准评估的无进展生存期(PFS)、客观缓解率(ORR)和疾病控制率(DCR)以及安全性。同时在全球队列中评估了6年随访时的OS和严重不良事件(SAEs)。
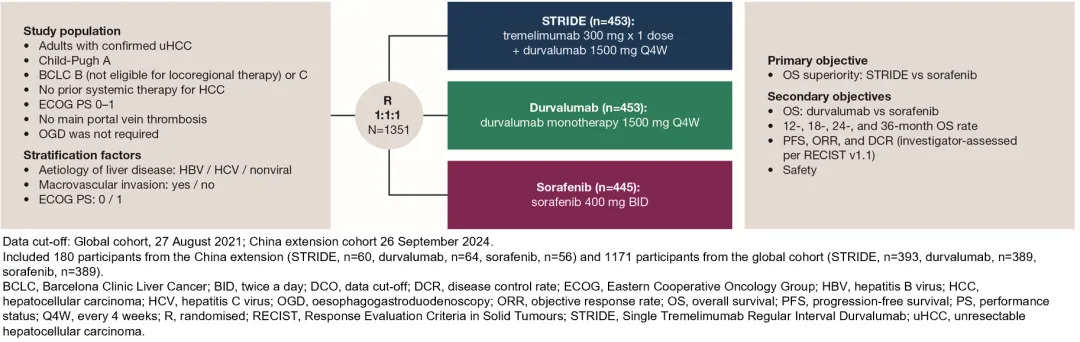
图1 HIMALAYA研究设计:中国扩展队列和全球队列合并分析
(引自2025ESMO Poster截图)
PART.03
研究结果
患者基线特征
在中国扩展队列及全球队列中,各治疗组基线特征总体保持平衡。36.6%的受试者存在基线HBV感染,其中STRIDE方案组、度伐利尤单抗组和索拉非尼组分别占37.3%、35.5%和37.1%。中国扩展队列的基线HBV感染率为75.0%。
表1 中国扩展队列和全球队列汇总的患者疾病特征
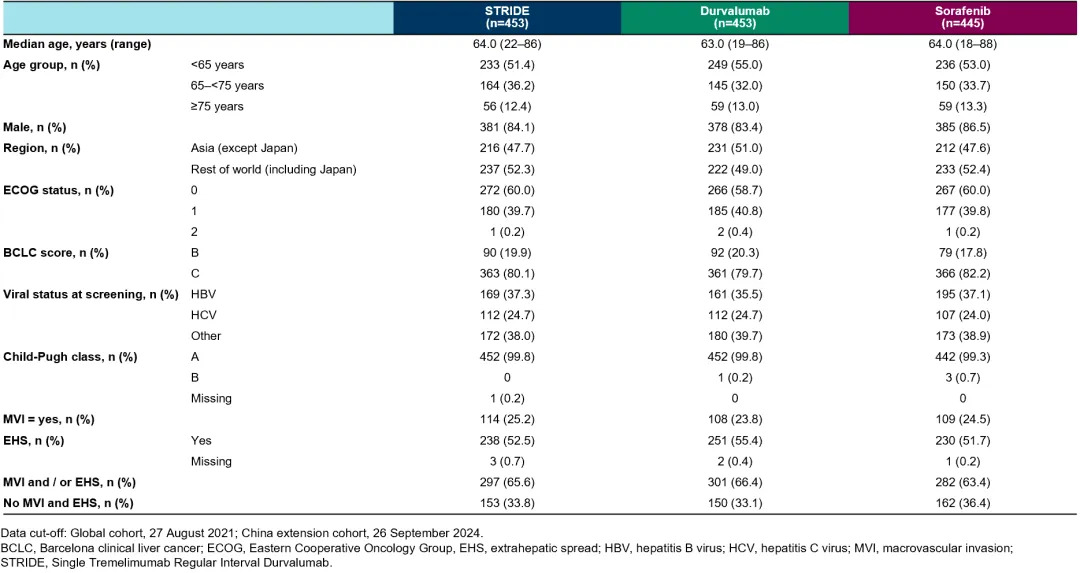
(引自2025ESMO Poster Supplemental Table截图)
OS数据
中国扩展队列和全球队列的汇总分析显示,与索拉非尼相比,STRIDE方案在OS方面展现出具有临床意义的改善,中位OS分别为17.35个月和13.63个月(HR=0.76;95%CI,0.65-0.89),12个月、18个月、24个月和36个月的OS率分别为60.3% vs 55.2%、49.2% vs 41.9%、41.4% vs 33.0%、31.0% vs 21.0%。该结果与全球队列主要分析结果一致。
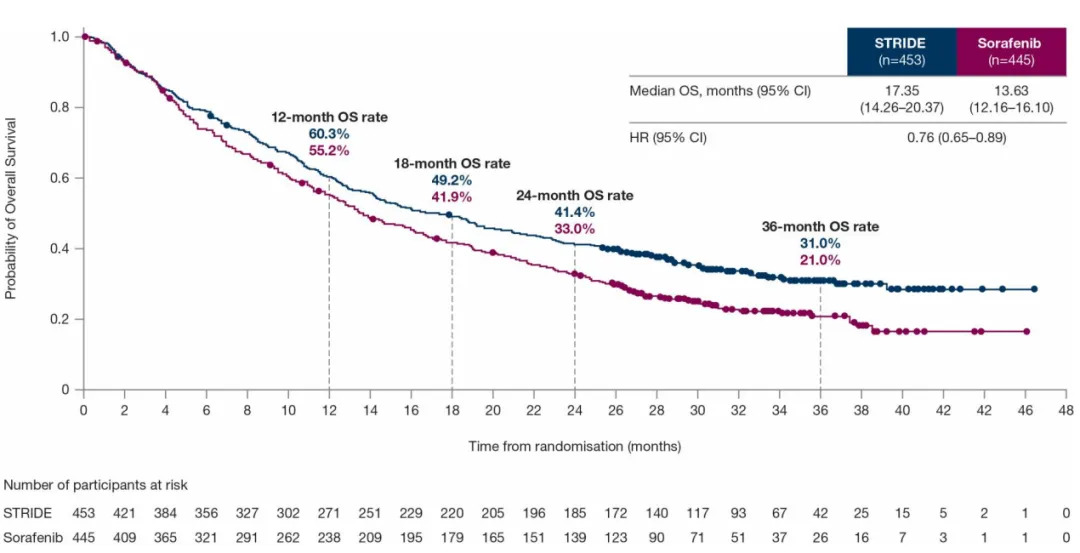
图2 中国扩展队列和全球队列汇总分析中STRIDE方案组和索拉非尼组的OS数据
(引自2025ESMO Poster截图)
同时,度伐利尤单抗组同样显示出相较于索拉非尼更优的疗效,两组中位OS分别为16.76个月和13.63个月(HR=0.85;95%CI,0.73-0.99)。
特别值得关注的是,全球队列的6年随访数据显示,与索拉非尼相比,STRIDE方案展现出持续的OS获益(两组中位OS分别为16.43个月和13.77个月,HR=0.76;95%CI,0.65-0.89),且STRIDE方案相较索拉非尼组的6年OS率几乎翻倍(17.1% vs 8.9%)。此外,度伐利尤单抗组较索拉非尼组的OS同样持续获益,中位OS分别为16.56个月和13.77个月(HR=0.86;95%CI,0.74-1.00),6年OS率分别为10.8%和8.9%。
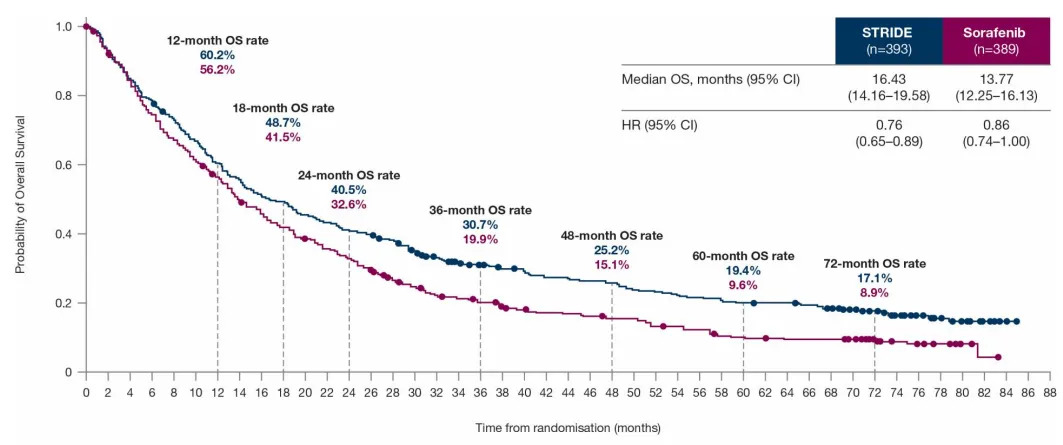
图3 全球队列中STRIDE方案组和索拉非尼组的OS数据
(引自2025ESMO Poster截图)
PFS、ORR数据
在中国扩展队列和全球队列的汇总分析中,STRIDE方案组、度伐利尤单抗组及索拉非尼组的中位PFS分别为3.78个月、3.58个月与3.91个月。STRIDE方案组(21.0%)与度伐利尤单抗组(16.1%)的ORR均高于索拉非尼组(4.9%)。
表2 中国扩展队列和全球队列汇总分析的PFS、ORR数据
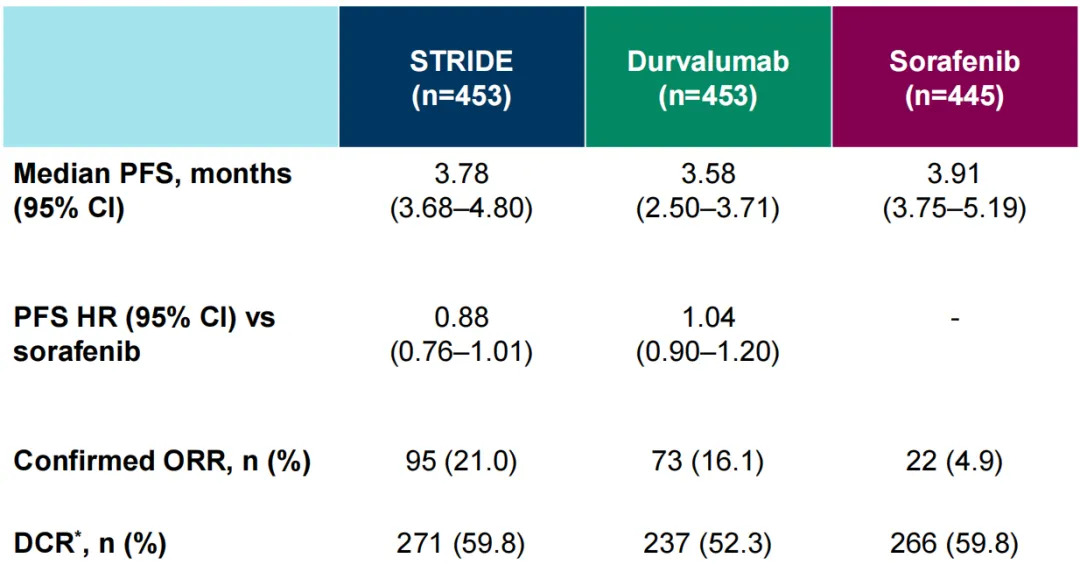
(引自2025ESMO Poster截图)
安全性数据
中国扩展队列和全球队列的汇总分析显示,STRIDE方案中度伐利尤单抗的中位治疗持续时间(范围)为5.5个月(0.3-43.9),度伐利尤单抗单药治疗组为4.7个月(0.2-44.4),索拉非尼治疗组的中位治疗持续时间(范围)为3.9个月(0.1-38.6),提示患者对STRIDE方案耐受性良好。
STRIDE方案组与度伐利尤单抗组的任意治疗相关不良事件(TRAE)发生率均低于索拉非尼组(76.1%、51.9%、85.8%),3级或4级TRAE发生率同样低于索拉非尼组(26.3%、12.6%、38.0%)。全球队列的主要分析后未再报告STRIDE方案组的其他严重TRAE,安全性可控可管理。
表3 中国扩展队列和全球队列汇总分析的安全性数据
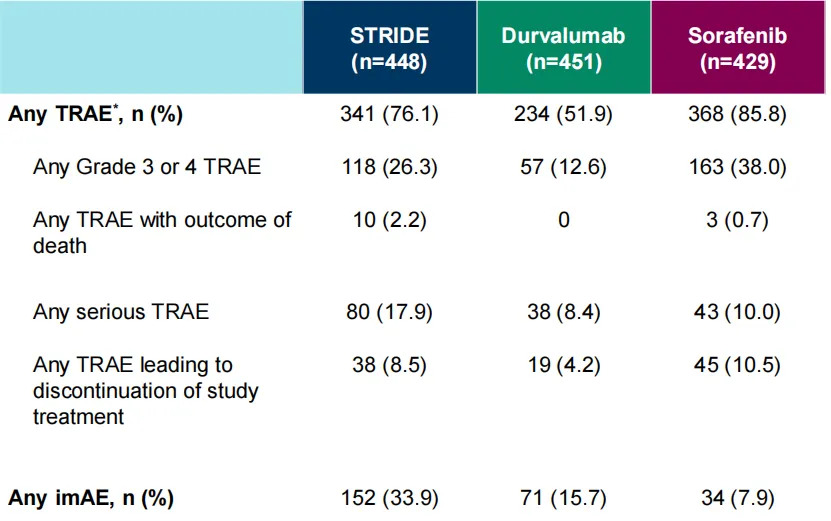
(引自2025ESMO Poster截图)
PART.04
研究结论
本次HIMALAYA研究中国扩展队列及全球队列的汇总分析表明,STRIDE方案与度伐利尤单抗相较于索拉非尼均展现出疗效提升,且安全性可控,这为STRIDE方案或度伐利尤单抗治疗全球多样化uHCC患者群体(包括HBV感染患者)的临床价值提供了支持。此外,全球队列6年的随访数据表明STRIDE方案能够持续带来OS获益,并始终保持可控的安全性特征。
秦叔逵教授解读
锚定本土需求,HIMALAYA研究筑牢双免方案在中国人群中的获益循证根基
近年来,免疫治疗的快速发展为晚期肝细胞癌(HCC)患者的生存获益带来了显著提升,其中,双免疫等联合治疗方案逐渐成为uHCC患者一线治疗的重要选择。2022年,全球III期临床试验HIMALAYA研究首次公布了阳性结果,PD-L1抑制剂度伐利尤单抗联合CTLA-4抑制剂tremelimumab(STRIDE方案)相较索拉非尼为患者带来了显著生存获益且安全性可控3。在此后的持续随访中,STRIDE方案始终维持明显的生存获益,该方案也在美国、欧盟和日本等多个国家/地区获批用于治疗uHCC患者。
2025年CSCO大会上,HIMALAYA研究再次公布了中国大陆、中国香港及中国台湾的合并队列结果,与索拉非尼相比,STRIDE方案显示出具有临床意义的OS改善(两组中位OS分别为25.26个月和14.09个月;HR=0.60;95%CI,0.42–0.84),且STRIDE方案和度伐利尤单抗单药均展现出良好获益-风险特征,与全球队列的主要分析结果一致7。回顾此前发表的中国香港地区及中国台湾地区数据,患者的中位OS长达29.4个月,为HCC领域目前已公布*III期研究中的中国人群领先数据,安全性和耐受性趋势与全球结果高度一致6,这些前期结果,已充分证实STRIDE方案可为中国患者群体带来较高比例的肿瘤缓解与显著的长期生存获益。
本次ESMO大会中,HIMALAYA研究对中国扩展队列和全球队列的汇总分析结果进一步展现出STRIDE方案对比索拉非尼在OS方面的改善,降低患者的死亡风险24%(HR=0.76;95%CI,0.65-0.89),且STRIDE方案组的12个月、18个月、24个月和36个月OS率在数值上均较索拉非尼组更高,与全球队列的主要分析结果一致1,表明STRIDE方案可为包括中国患者在内的广泛全球患者带来生存获益。
值得关注的是,中国是乙肝大国,多数肝癌患者存在HBV感染,HIMALAYA研究中国扩展队列和全球队列的汇总分析中,STRIDE方案组和索拉非尼组分别纳入了37.3%和37.1%的基线HBV感染者,且中国扩展队列的基线 HBV 感染率(75.0%)高于全球队列(30.7%),这一差异符合中国临床实践中HCC患者群体的疾病特征。在这部分高HBV感染负荷的患者群体中,STRIDE方案仍取得了良好疗效,且与全球队列的主要分析结果一致。在HBV患者中,HBV免疫激活后可能发生急性肝毒性。前期研究表明,STRIDE方案的肝毒性风险可控8。总而言之,这些结果夯实了STRIDE方案在中国 HBV 感染的uHCC患者群体中的适用性。
安全性方面,合并分析中,STRIDE 方案组的任意TRAE和3-4级TRAE发生率均低于索拉非尼组,提示STRIDE方案整体耐受性良好,不良事件可控可管理。在免疫介导相关不良事件(imAE)上,此前HIMALAYA研究发表的全文显示,STRIDE方案组imAE发生率为35.8%,但不增加肝脏或出血风险,3-4级ALT/AST升高率、肝炎发生率均较低,无治疗相关肝毒性死亡,且探索性分析提示imAE的发生不会影响STRIDE方案的OS获益,无论患者是否发生imAE,患者均可从STRIDE方案中长期获益8。本次公布的汇总分析结果中,STRIDE方案组imAE发生率为33.9%,与全球结果一致,可控可管理。需要强调的是,imAE的管理是STRIDE方案临床应用中的重要考量,建议建立完善的imAE识别、监测和处理流程,包括定期监测肝功能、甲状腺功能等关键指标,及时介入以确保患者安全。
此外,全球队列长达6年的随访数据显示STRIDE方案具有持久且显著的OS获益,6年OS率相较索拉非尼几乎翻倍(17.1% vs 8.9%)1,充分贴合免疫治疗常见的“长尾效应”,为uHCC患者迈入长期生存新时代再添力证。
同样值得关注的是,一项专门针对中国uHCC患者的HIMALAYA IIIb期研究TREMENDOUS(NCT05557838)也正在进行中,该研究共纳入150例中国uHCC患者,旨在评估STRIDE方案作为中国uHCC患者一线治疗的安全性和疗效9。该研究中,患者中位年龄60岁,大多体能状态较好(ECOG PS 0分:75.3%);总体分期较晚(BCLC C期:74.0%)且伴HBV感染(83.3%)比例较高,符合中国临床实际。研究显示,研究者根据RECIST v1.1标准评估的ORR达34%,中位OS尚未达到,但80.7%的9个月OS率提示STRIDE方案可能将在长期生存方面展现出良好的获益预期。
HIMALAYA研究的长期生存随访及其数据公布,再次有力地证实了双免治疗方案的“拖尾效应”。这一成果使HCC能与肺癌、乳腺癌等癌种比肩,开始以“五年及以上的生存率”来衡量疗效,为整个肿瘤学界带来了深远启迪。
小结与展望
HIMALAYA研究历经六年随访,以坚实的循证数据交出了一份令人瞩目的答卷。STRIDE方案不仅在中国扩展队列和全球队列汇总分析中展现出对全球多样化uHCC人群一致的生存获益与可控的安全性,更在中国高HBV感染负荷的患者中显示出良好疗效,且STRIDE方案整体耐受性良好,不良事件可控可管理,凸显其针对中国人群的特殊价值。尤为重要的是,该方案实现了uHCC一线治疗领域迄今*最长的生存随访记录——6年OS率较标准治疗几乎翻倍,标志着双免联合治疗正持续助力患者实现长期带瘤生存。
展望未来,随着HIMALAYA IIIb期TREMENDOUS研究等针对中国人群的探索深入推进,STRIDE方案有望为中国uHCC患者提供更精准、更有效的治疗选择,进一步夯实其在全球及中国临床实践中的基石地位,持续引领肝癌治疗格局的演进。
*截至发稿日
参考文献:
1.Bruno Sangro, Shukui Qin, Robin K. Kelley, et al. Pooled efficacy and safety outcomes with tremelimumab plus durvalumab in participants with unresectable hepatocellular carcinoma from the combined China extension and global cohorts in the Phase 3 HIMALAYA study. 2025 ESMO.
2.曹广文. 我国原发性肝癌的流行病学特征及精准防控[J]. 广西医科大学学报, 2024, 41(11): 1455-1463.
3.Abou-Alfa GK, Lau G, Kudo M, et al. Tremelimumab plus Durvalumab in Unresectable Hepatocellular Carcinoma. NEJM Evid. 2022 Aug;1(8):EVIDoa2100070.
4.中国临床肿瘤学会指南工作委员会. CSCO原发性肝癌诊疗指南2024.
5.NCCN Clinical Practice Guidelines in Oncology:Hepatocellular Carcinoma(Version 2.2025).
6.廖家杰, 等. Tremelimumab 联合度伐利尤单抗用于不可切除肝细胞癌 3 期HIMALAYA 研究全球和亚洲人群 5 年总生存期和基于肿瘤缓解的总生存期数据更新. 2024CSCO.
7.Qin S, et al. Pooled efficacy and safety outcomes with tremelimumab plus durvalumab in participants with unresectable hepatocellular carcinoma from the combined China mainland extension and Hong Kong and Taiwan subgroups in the Phase 3 HIMALAYA study.2025CSCO.
8.George Lau, et al. Outcomes by occurrence of immune-mediated adverse events with tremelimumab plus durvalumab in the Phase 3 HIMALAYA study in unresectable hepatocellular carcinoma. 2023 ASCO. Abstract4004.
9.Jia F, et al. Durvalumab and Tremelimumab as First-line Treatment in Patients with Unresectable Hepatocellular Carcinoma: Interim Analysis of An Open-label, Multi-center Phase IIIb Study (TREMENDOUS study). 2025 APASL LB0003.


